سالک (لیشمانیوز پوستی): علائم، تشخیص، درمان و پیشگیری
نویسنده: دکتر مهوش کریمی دخت
سالک یا لیشمانیوز پوستی (Cutaneous Leishmaniasis) یک بیماری انگلی مهم و نادیدهگرفتهشده است که توسط گونههای مختلف انگل Leishmania و از طریق گزش پشه خاکی ماده به انسان منتقل میشود. این بیماری علاوه بر بار بهداشتی، پیامدهای روانی–اجتماعی و زیباییشناختی چشمگیری دارد؛ زیرا ضایعات پوستی آن میتواند اسکارهای دائمی بر جای بگذارد. سازمان جهانی بهداشت سالک را در فهرست بیماریهای گرمسیری نادیدهگرفتهشده طبقهبندی میکند و برآورد میشود سالانه بین ۷۰۰ هزار تا یک میلیون مورد جدید در جهان رخ دهد [1][2].
ایران یک کشور اندمیک برای سالک است و طبق گزارشهای رسمی، سالانه حدود
۱۹ هزار مورد ابتلا ثبت میشود که نزدیک به
۳ هزار مورد آن در استان فارس گزارش شده است [3][4].
چرخه زندگی انگل شامل دو میزبان است: میزبان مهرهدار (انسان یا حیوان) که انگل به صورت آماستیگوت در ماکروفاژها زندگی میکند و ناقل بیمهره یعنی پشه خاکی (زیرخانواده Phlebotominae) که در رودهاش انگل به فرم پروماستیگوت تبدیل و تکثیر میشود.
هنگام گزش بعدی، پروماستیگوتها وارد پوست میزبان شده و مجدداً در ماکروفاژها به آماستیگوت تبدیل میگردند [1][5]. از نظر بالینی، سالک به دو الگوی اصلی خشک (شهری) و مرطوب (روستایی) تقسیم میشود که تفاوتهای اپیدمیولوژیک و بالینی مهمی دارند [6][7].
دو الگوی بالینی غالب در ایران:
۱) سالک خشک (شهری) ← L. tropica
۲) سالک مرطوب (روستایی) ← L. major
ناقلین کلیدی: Phlebotomus sergenti و P. papatasi [6][7][8]
۱) تاریخچه و اهمیت بهداشت عمومی
توصیفات بالینی ضایعاتی شبیه سالک در متون پزشکی باستانی خاورمیانه مشاهده شده است، اما شناخت انگل لیشمانیا و نقش پشهخاکی به قرن بیستم بازمیگردد.
در ایران، گزارش های اپیدمیولوژیک کلاسیک از دهه ۱۹۷۰ میلادی، الگوهای شهری و روستایی را تفکیک و نقش جوندگان و سگ ها را در مخزن بیماری روشن کردهاند [6][8]. اهمیت بهداشتی سالک، علاوه بر شیوع، در بار ناتوانی ناشی از اسکارهای قابل مشاهده و پیامدهای اقتصادی–اجتماعی آن نهفته است؛ به خصوص در کودکان و زنان که اثر بر کیفیت زندگی و مشارکت اجتماعی پررنگتر است [9][10].
۲) عامل بیماری، گونه ها و چرخه زیستی
گونههای متعددی از Leishmania میتوانند ضایعات جلدی ایجاد کنند. در ایران دو گونه غالب عبارتاند از: L. tropica (سالک خشک) و L. major (سالک مرطوب) [6][7]. تفاوتهای ژنتیکی و ویژگیهای ویرولانس این گونه ها در شدت التهاب موضعی و الگوی ضایعات نقش دارند. چرخه زیستی شامل انتقال آماستیگوتها از میزبان مهرهدار
به ناقل و تبدیل آن ها به پروماستیگوت در روده پشهخاکی است. سپس پروماستیگوتهای متحرک در بزاق یا خرطوم ناقل به پوست میزبان دیگر منتقل میشوند و با ورود به ماکروفاژها، دوباره به آماستیگوت تبدیل شده و تکثیر میکنند [1][5].
۳) ناقل ها و مخازن
ناقلین اصلی در ایران جنس Phlebotomus هستند. Ph. papatasi بیشتر با سالک مرطوب (ناحیههای روستایی) و Ph. sergenti با سالک خشک (کانونهای شهری) مرتبط است [7][8].
مخازن حیوانی در سالک مرطوب غالباً جوندگان بیابانی مانند Rhombomys opimus (جربیل بزرگ) و گونههای Meriones هستند. در الگوی شهری، انسان مخزن اصلی تلقی میشود و سگ ها نیز میتوانند آلوده شوند [6][7][11].
۴) کلینیک، سیر بیماری و انواع بالینی
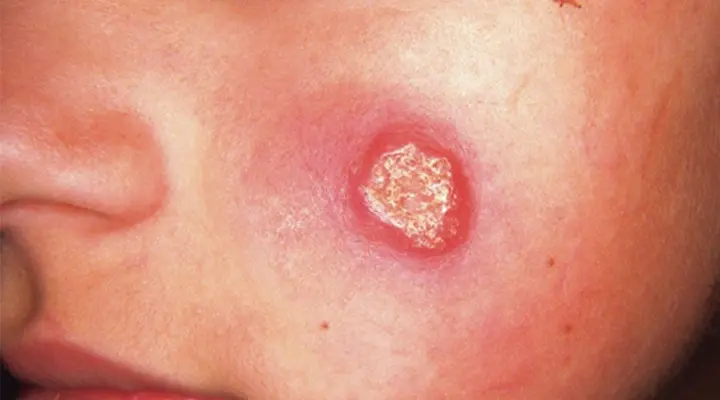
۴.۱) سالک خشک (شهری)
ضایعه اغلب به صورت پاپول یا گره قرمز آغاز می شود و طی چند ماه به پلاک یا زخم خشک و محدود تبدیل میگردد. درگیری معمولاً تککانونی است و روند بهبود خودبهخودی میتواند ۸ تا ۱۲ ماه طول بکشد، با احتمال اسکار فرورفته [6][12].
۴.۲) سالک مرطوب (روستایی)
معمولاً چند هفته پس از گزش بروز میکند، ضایعات متعددتر و ترشحدار هستند و لبههای فعال دارند. روند بهبود معمولاً سریعتر از نوع شهری (حدود ۴–۶ ماه) است؛ اما اسکار برجایمانده شایع است [7][12].
۴.۳) فرمهای کمتر شایع و پیچیده
- سالک منتشر (Diffuse CL): ضایعات متعدد و گسترده در بیماران با اختلال ایمنی سلولی، پاسخ ضعیف به درمانهای استاندارد [1].
- عودکننده (Lupoid leishmaniasis): پلاکهای مزمن با لبههای برجسته که ممکن است سالها پایدار بمانند و درمانشان دشوار باشد [12].
- درگیری مخاطی (CL-Mucosal overlap): نادر در ایران، اما باید در سفرکردگان به کانونهای آمریکای لاتین مدنظر باشد [1][13].
۵) اپیدمیولوژی جهانی و ایران
لیشمانیوز پوستی در بیش از ۸۰ کشور اندمیک است. برآورد WHO نشان میدهد سالانه بین۷۰۰,۰۰۰ تا ۱,۰۰۰,۰۰۰ مورد رخ میدهد [2]. ایران، افغانستان، پاکستان، عربستان، سوریه و عراق از کانونهای مهم منطقهای هستند [1][2][4].
در ایران، الگوهای تاریخی نشان دادهاند که استان های فارس، اصفهان، کرمان، خوزستان و سیستان و بلوچستان سهم بالایی در بروز دارند [4][6][14].
استان فارس بهویژه شهر شیراز و پیرامون آن از کانونهای پایدار سالک است و حدود
۳ هزار مورد سالانه به این استان نسبت داده شده است؛
تغییرات اقلیمی، خشکی تالاب ها و افزایش تماس انسان–مخزن از عوامل مؤثر هستند [3][14][15].
۶) تشخیص: بالینی، پارازیتولوژیک و مولکولی
- ارزیابی بالینی: زخم مزمن، لبههای فعال، پاسخ ناکافی به آنتیبیوتیکهای معمول؛ محلهای در معرض گزش (صورت، دست، پا) [12].
- اسمیر مستقیم و رنگآمیزی گیمسا: مشاهده آماستیگوتهای داخلسلولی در ماکروفاژها (روش سریع و کمهزینه) [16].
- کشت در محیط NNN یا مشابه: برای تکثیر پروماستیگوتها و تأیید آزمایشگاهی [1][16].
- PCR و سنجش های مولکولی: حساسیت و اختصاصیت بالا و امکان تفکیک گونهها؛ کاربرد ویژه در موارد با اسمیر منفی [17].
- تشخیص افتراقی: زردزخم، زخمهای قارچی، سل پوستی، زخمهای ناشی از گزش حشرات دیگر و سرطانهای پوستی باید کنار گذاشته شوند [12][18].
۷) درمان: استانداردهای کلاسیک و رویکردهای نوین
۷.۱) آنتیموانهای پنجظرفیتی (گلوکانتین/مگلومین آنتیمونیات)
تزریق داخل ضایعهای یا سیستمیک گلوکانتین درمان خط اول بسیاری از کانونها است، هرچند مقاومت دارویی و عوارض (کبدی/قلبی) باید مدنظر باشد [19][20]. پایبندی به دوره درمان و پایش عوارض، موفقیت درمان را افزایش میدهد. برخی مطالعات ایرانی مقاومت L. tropica را گزارش کردهاند [21].
۷.۲) آمفوتریسین B (فرم لیپوزومال در موارد منتخب)
در موارد مقاوم یا پیچیده، آمفوتریسین B (بهویژه لیپوزومال) میتواند مؤثر باشد؛ توجه به نفروتوکسیسیته و تنظیم دوز ضروری است [22].
۷.۳) کرایوتراپی و روشهای فیزیکی
کرایوتراپی با نیتروژن مایع، به ویژه برای ضایعات محدود، کاربرد فراگیر دارد. ترکیب کرایو با آنتیموان پنجظرفیتی نتایج بهتری نشان داده است [23]. الکتروتراپی و حرارت موضعی نیز در برخی پروتکلها استفاده میشوند [18][23].
۷.۴) درمانهای جدید و بومی در ایران
پمادهای موضعی بر پایه آمفوتریسین B (مانند فرآوردههای داخلی نظیر «سینا آمفولیش») در کارآزماییها نتایج امیدبخشی نشان دادهاند و بهعنوان گزینه کمکی یا جایگزین در ضایعات انتخابشده مطرحاند [24].
۷.۵) نکات عملی درمان
- انتخاب درمان بر اساس گونه احتمالی، اندازه و محل ضایعه، تعداد ضایعات، سن و وضعیت ایمنی بیمار انجام شود [18][25].
- درگیری صورت، ضایعات بزرگتر از ۴–۵ سانتیمتر، چندکانونی یا نزدیک مفاصل نیاز به توجه ویژه و گاه درمان سیستمیک دارند [18].
- پیگیری ۳–۶ ماهه برای ارزیابی پاسخ و عود ضروری است [18][25].
ترکیب کرایوتراپی + تزریق داخلضایعهای آنتیموان در بسیاری از مطالعات منطقهای، اثربخشی و سرعت بهبود را بهطور معنیداری افزایش داده است [23][25].
۸) پیشگیری و کنترل: فردی، محیطی و برنامههای جمعیتی
۸.۱) اقدامات فردی
- استفاده از پشهبند و توری های ریزروی در و پنجره، به ویژه در خواب شبانه [18][26].
- بکارگیری دافع حشرات روی پوست و لباس در ساعات اوج فعالیت پشه خاکی (غروب تا شب) [5][18].
- پوشش مناسب اندام های باز (آستین بلند، شلوار بلند) در مناطق اندمیک [18].
۸.۲) اقدامات محیطی و جمعیتی
- بهسازی محیط، جمعآوری نخالهها و مدیریت پسماند برای حذف محلهای زیست پشه خاکی [18][26].
- کنترل مخازن جونده در کانونهای روستایی با پروتکلهای استاندارد و پایش مستمر [7][11][18].
- آموزش جامعه، شناسایی زودهنگام و ارجاع به موقع بیماران به مراکز درمانی [18][26].
۹) پیامدهای روانی – اجتماعی و کیفیت زندگی
اسکارهای صورت و اندامها میتواند موجب انگ اجتماعی، کاهش اعتمادبهنفس، اضطراب و حتی افسردگی شود. پژوهش ها کاهش امتیاز کیفیت زندگی در مبتلایان سالک را نشان دادهاند؛ بنابراین مداخلات روانشناختی و حمایت اجتماعی همراه درمان طبی توصیه میشود [9][10].
۱۰) پژوهشهای نوین، واکسن و آینده درمان
توسعه واکسنهای نسل دوم علیه لیشمانیوز همچنان در دست بررسی است و پلتفرمهای مختلف پروتئینی و DNA در حال مطالعهاند [27]. از سوی دیگر، فرآوردههای موضعی جدید و سیستمهای دارورسانی (مانند لیپوزومها و نانوفناوری) بهمنظور افزایش اثربخشی و کاهش عوارض در حال رشد هستند [22][24].
در ایران نیز تلاشهای قابل توجهی برای داروهای موضعی، بهینهسازی درمان ترکیبی و راهنماهای منطقهای مدیریت بیماری انجام شده است [24][26].
۱۱) سالک در استان فارس و نقش کلینیک های تخصصی
استان فارس به دلیل شرایط اقلیمی، وجود ناقلین و مخازن بومی، و تماس گسترده انسان–محیط، کانون شناختهشده سالک است [3][14][15]. در شهر شیراز و شهرستانهای اطراف، شبکه بهداشت و کلینیکهای تخصصی نقش محوری در شناسایی، درمان سریع و پیشگیری از اسکار دارند.
ارجاع به موقع و انتخاب درمان مناسب بر حسب نوع ضایعه، گونه محتمل و شرایط فردی، کلید کاهش عوارض زیبایی و اجتماعی است [18][26].
درمان زودهنگام در کانونهای اندمیک مانند فارس، زمان بهبود را کوتاه و احتمال
اسکار دائمی
را کاهش میدهد [18][23][25].
جمعبندی
سالک یک بیماری انگلی با بار مهم بهداشتی و اجتماعی در ایران است. فهم دقیق چرخه زیستی، نقش ناقل و مخزن، تفاوتهای بالینی و بهکارگیری تشخیصهای پارازیتولوژیک و مولکولی، راه را برای مدیریت مؤثر هموار میسازد. درمان استاندارد با آنتیموان پنجظرفیتی و کرایوتراپی همچنان ارکان اصلیاند، اما رویکردهای نوین (آمفوتریسین B لیپوزومال، فرآوردههای موضعی جدید و درمانهای ترکیبی) افقهای تازهای گشودهاند. برنامههای پیشگیری مبتنی بر بهسازی محیط، کنترل ناقل/مخزن و آموزش جامعه، بهویژه در کانون های فعال مانند استان فارس، حیاتی است. با توجه به پیشرفتهای پژوهشی داخلی و بینالمللی، چشمانداز کنترل بهتر بیماری و کاهش بار ناشی از اسکار و پیامدهای روانی–اجتماعی نویدبخش است [1][2][18][23][26][27].
منابع
- Reithinger R, Dujardin JC, Louzir H, Pirmez C, Alexander B, Brooker S. Cutaneous leishmaniasis. Lancet Infect Dis. 2007;7(9):581–596. DOI:10.1016/S1473-3099(07)70209-8
- World Health Organization (WHO). Leishmaniasis – Fact sheet (updated). Link
- Ministry of Health and Medical Education of Iran (MOHME). Annual report on cutaneous leishmaniasis cases in Iran; 2023. (دادههای رسمی وزارت بهداشت)
- Alvar J, Vélez ID, Bern C, et al. Leishmaniasis worldwide and global estimates of its incidence. PLoS One. 2012;7(5):e35671. DOI:10.1371/journal.pone.0035671
- CDC. Leishmaniasis: Epidemiology & Risk Factors (Clinicians). Link
- Nadim A, Javadian E. Epidemiology of leishmaniasis in Iran. Acta Trop. 1976;33(4):363–367. DOI:10.1016/0001-706X(76)90046-6
- Yaghoobi-Ershadi MR. Phlebotomine sand flies in Iran and their role in Leishmania transmission. J Arthropod-Borne Dis. 2012;6(1):1–17. PMCID: PMC3750867
- Killick-Kendrick R. The biology and control of phlebotomine sand flies. Clin Dermatol. 1999;17(3):279–289. DOI
- Toledo AC Jr, et al. Quality of life in patients with cutaneous leishmaniasis. Am J Trop Med Hyg. 2013;89(5):839–843. DOI:10.4269/ajtmh.13-0202
- WHO-EMRO. Manual for case management of cutaneous leishmaniasis in EMR; 2014. PDF
- Bensoussan E, et al. Comparison of PCR assays for diagnosis of CL. J Clin Microbiol. 2006;44(4):1435–1439. DOI
- Hepburn NC. Cutaneous leishmaniasis: an overview. J Postgrad Med. 2003;49(1):50–54. PMID:12686550
- Control of the leishmaniases: WHO Expert Committee Report, TRS No.949; 2010. PDF
- Shirzadi MR, et al. Epidemiological status of CL in Iran 1983–2012. Iran J Public Health. 2015;44(3):299–307. PMCID: PMC4441941
- Gurel MS, Ulukanligil M, Ozbilge H. Cutaneous leishmaniasis: a great imitator. Clin Dermatol. 1999;17(3):249–256. DOI
- Asilian A, et al. Cryotherapy for cutaneous leishmaniasis. Int J Dermatol. 2004;43(7):551–555. DOI
- WHO. Leishmaniasis: Clinical management (guidance). Link
- PAHO/WHO. Leishmaniasis: guidelines and manuals (Regional). Link
- Sundar S, Chakravarty J. Antimony toxicity. Int J Environ Res Public Health. 2010;7(12):4267–4277. DOI
- Sundar S, et al. Oral miltefosine for Indian visceral leishmaniasis. N Engl J Med. 2002;347:1739–1746. DOI
- Hadighi R, et al. Unresponsiveness to Glucantime in Iranian CL due to drug-resistant L. tropica. PLoS Med. 2006;3(5):e162. DOI
- Ambisome (liposomal amphotericin B): Prescribing information (safety profile). FDA Label
- WHO-EMRO. Guidelines for cutaneous leishmaniasis surveillance and control (Eastern Mediterranean). Link
- Reports on topical amphotericin B formulations for CL (Iranian clinical trials overview). PubMed search
- CDC. Clinical Care of Cutaneous Leishmaniasis. Link
- Coler RN, Reed SG. Second-generation vaccines against leishmaniasis. Trends Parasitol. 2005;21(5):244–249. DOI




تا کنون نظری ثبت نشده است